Ein neues tropisches Phyllosiphon‚
seine Lebensweise und Entwicklung ¹).
Von
F. Tobler.
Mit Tafel I und 11 Textfiguren.
————
Während meines Aufenthaltes im Biologisch-Landwirtschaftlichen Institut Amani (D.-Ost-Afrika) von Oktober 1912 bis März 1913 habe ich ein neues Phyllosiphon in einer Aracee beobachtet. Es ist mir, trotzdem meine Hauptarbeit nicht darauf verwendet wurde, gelungen, die Natur und den Entwicklungsgang dieses Organismus mit leidlicher Vollständigkeit zu erfassen. Was bei dem bekannten Phyllosiphon Arisari Kühn in Europa erst mühsam zusammengetragen worden ist, ließ sich hier und an der Hand der erschöpfenden Zusammenstellungen für die Verwandte fast auf einmal aufdecken. Die Deutlichkeit und Größe des tropischen Gegenstandes erlaubte zudem manches aufzuklären und zu ergänzen, was auch für die Betrachtung der ganzen Organismengruppe Wert hat. Für die Einreihung in die Nähe anderer Siphoneen gaben mir weit zurückliegende und zum Teil noch unveröffentlichte Siphoneenstudien aus Neapel einigen Anhalt.
Das Phyllosiphon asteriforme mihi bildet bis fast pfenniggroße, mit bloßem Auge deutlich sichtbare Flecke von hellerer, meist ins Gelbliche gehender Farbe auf den Blättern von Zamioculcas zamiifolia. Es ist mit keinem bisher beschriebenen Organismus identisch, es nimmt das bei seiner Größe und seinen auffallenden
Eigenschaften wunder. Doch war eine brauchbare Beschreibung nur durch Beobachtung seiner Entwicklung zu erwarten.
Herrn Professor Dr. A. Zimmermann - Amani, meinem Freunde und Förderer aller meiner dortigen Arbeiten, war das Vorkommen des auffälligen Parasiten längst bekannt, ihm verdanke ich auch den ersten Hinweis auf die Erscheinung. Den Aufenthalt in Amani und damit auch die Möglichkeit zu dieser Arbeit verdanke ich dem Reichskolonialamt, das mir das Tropenreisestipendium 1912 verlieh.
1) Diese Arbeit war als Beitrag zur Pfeffer-Festschrift 1915 angesetzt. Die Mobilmachung 1914 überraschte mich noch im letzten Abschluß des Manuskriptes. Erst eine Muße im Lazarett gab mir Gelegenheit dazu. Ostern 1916. T.
1. Die Wirtspflanze.
Zamioculcas zamiifolia (Lodd.) Engler¹) ist eine stattliche Aracee (zu den Pothoideen gehörig), die sich bei Amani im feuchten Walde nahe Bachufern, stets an sehr schattigen Stellen, häufig findet. Ich habe eine Reihe von Standorten am Kwamkujo und am Sigi in Entfernungen von 1—2 km von der Station für meine Untersuchungen zur Verfügung gehabt. Dort war sie mit dem Parasiten im Blatte reichlich zu finden. An trockneren Stellen weniger üppig wachsende Exemplare waren auch vielfach ohne die Krankheit zu beobachten. Ich verpflanzte auch Exemplare der Zamioculcas in den Wald unmittelbar beim Laboratorium und am Wege, wo es — außerhalb des Bachbereichs und Dickichts — weniger geeigneter Standort sein mußte. An diesen führte ich die Infektionsversuche aus, sie glückten, wie gezeigt wird, mit einiger Mühe doch, auch schon infiziert gewesene ließen den Parasiten dort ausreifen.
1) A. Engler, Pflanzenwelt Afrikas II, 1, S. 240.
Die Pflanze besitzt bis 50 cm lange, gefiederte Blätter, deren Fiedern übrigens nach dem Abfallen an ihrem unteren Ende Knollen und an diesen neue Sprosse entwickeln können²).
2) Wie Engler angibt. In Amani habe ich nicht viel von dieser Vermehrung wahrnehmen können.
Die Fiederblätter sind von wechselnder Größe (vgl. die Abbildungen infizierter) und saftiger bis dicklederiger Beschaffenheit, die Farbe meist frisch grün, alte auch wirklich dunkelgrün. Von den Fiedern eines Blattes sind gleichzeitig selten mehr als drei Paare vorhanden, sehr oft weniger. Die älteren Blätter sterben in Amani im Anfang des Jahres vielfach ab. Um diese Zeit findet man vielfach die Blätter angefressen. Gerade die Flecke mit dem
Schmarotzer werden oft herausgefressen, von was für Tieren, vermag ich nicht zu sagen. Um diese Zeit sind die Schläuche der Alge zweifellos viel inhalts- (nährstoff-) reicher als das Blattgewebe des Wirtes. Das ist also dort zwischen der kleinen und der großen Regenzeit, bald nach der ersteren und in einer oft recht trocknen Periode. Bis etwa in den März stehen die Pflanzen ohne frische Blätter da, nur sehr wenige ältere halten durch, doch erscheinen junge fast das ganze Jahr hindurch aus dem Grunde und jungen Knollen zu entstehen, im lebhaften Wachstum sind sie aber erst in der zweiten Hälfte des Jahres, um gegen Ende des Jahres mehr und mehr einzuziehen. Selbst von den im Dezember gebildeten Blättern gehen im Januar viele verloren. Sie werden gelb, auch ohne vorher die Dicke und Härte der älteren und ihre dunkle Farbe erreicht zu haben. Der Wechsel der Blätter dürfte an den feuchteren (günstigeren) Standorten der Aracee lebhafter sein. Auf andern Teilen der Wirtspflanze als auf den Blättern habe ich den Schmarotzer nicht gefunden.
Diese Bemerkungen zur Biologie der Wirtspflanze sind nicht ohne Bedeutung für die Biologie des Schmarotzers (vgl. im folgenden Abschnitt).
Auf die Anatomie des Blattes soll weiter unten eingegangen werden.
2. Entwicklungszeiten.
Gut entwickelte Schmarotzerthalli waren zu finden von Oktober an bis in den Anfang des Jahres. An äußerem Umfang nahmen sie im wesentlichen in dieser Zeit nicht mehr zu, doch trat die Reife des Inhalts erst allmählich in dieser Zeit zutage. Die jüngsten Stadien, deren Erwähnung zu tun sein wird, fand ich im Februar bis März vor, es gab im gleichen Zeitraum Thalli, die schon den halben Durchmesser der ausgewachsenen erreichten. Das heißt (zunächst für die von mir beobachtete Zeit): Reife Stadien zu Ende und nach der kleinen Regenzeit, junge Stadien in der zwischen dieser und der großen liegenden Zeitspanne und zwar gegen ihr Ende sich entwickelnd. Es folgt vom März—April an die große Regenzeit in Amani, die bis in den Juli dauert. Es liegt nahe anzunehmen, daß sich die im März schon halb entwickelten Thalli noch in der Regenzeit zur Reife entwickeln und daß die beim Beginn meiner Zeit (Herbst) gefundenen der Reife sich nähernden Zustände eine andere Generation sind.
Es sei hier hingewiesen auf die Zeiten, die Lagerheim (1892, S. 120 f.) für seine tropischen Schmarotzer verwandter Art angibt. Seine Phyllosiphon-Funde in Ekuador datieren (mit Sporen) von September bis Dezember. Soweit ich die angegebenen Fundorte feststellen und für diese die kärglichen klimatologischen Angaben auftreiben kann¹), liegen sie frühestens am Ende der größeren Trockenzeit, die aber noch sehr feucht zu sein pflegt, und erstrecken sich bis über die kleine Regenzeit oder aber fallen sogar noch ganz in den Schluß der großen Regenzeit. Jedenfalls also ist die Reife, die vielleicht einsetzt mit dem Absterben der Wirtspflanzenteile in einer verhältnismäßig trockneren Zeit, vollendet in einem Augenblick, wo feuchte Zeit herrscht, die Aussaat der Sporen erfolgt daher in der Feuchtigkeit.
1) Jul. Hann, Handbuch der Klimatologie II, 1, 3. Aufl. (Stuttgart 1910), S. 368.
Daß übrigens auch Phyllosiphon Arisari seine eigentliche Entwicklung in feuchterer Zeit durchmacht‚ hat Just (S. 55) hervorgehoben. Nach ihm ruht die Alge im Sommer und erscheinen die Flecken auf dem Wirt erst im Winter. Doch sollte nach Kühn die Reife ihrer Sporen durch Trockenheit gefördert werden, was für die tropischen Verwandten nicht zutreffen kann.
3. Das Auftreten des Schmarotzers.
Den Schmarotzer lernte ich zuerst im Oktober kennen in meist der Reife sich stark näherndem Zustande und äußerlich schon etwa auf der Höhe der Entwicklung. Er war dann leicht zu sehen in Gestalt von Flecken auf den Blättern. Die Größe der Flecke betrug durchschnittlich 1 cm Durchmesser, ihre Gestalt war kreisrund (wo sich nicht mehrere berührten), ihre Farbe heller als die des Blattes, zunächst meist noch grün und gleichmäßig, aber im Grunde heller als die Umgebung. Vielfach sind die Flecke polsterartig geschwollen. Sie treten durchweg nur auf der Blattoberseite bemerkbar hervor.
Es ist hier gleich hervorzuheben, daß hinsichtlich Farbe und Schwellung sich bei einigermaßen reichlichem Stoffe stets zwei Gruppen darunter unterscheiden ließen.
1) (Minderzahl) nicht geschwollene, oft erheblich große (bis über 1,5 cm D.M.) Flecken, hellgrün bis gelb, selbst ins
Rötlichgelbe übergehend und um so deutlicher abgehoben, als sie meist auf sehr dunklen Blättern sitzen.
2) (Die Mehrzahl) polsterartig geschwollene, bis etwa 1,25 cm D.M., hellgrün, aber weniger abgehoben, weil auf jüngeren (helleren) Blättern. In diesen Polstern treten im Lauf der Reife die Schläuche der Alge in Sternform deutlich und immer dunkler hervor. Im spätesten Stadium ist ein dunkler Stern zu erkennen, um diesen zunächst eine helle Ringzone, dann eine dunklere, beide etwa 1—2 mm breit und aus dem Blattgrund abgehoben. Die äußere, dunklere liegt schon in der Ebene des Blattes, die Anschwellung wird durch die hellere Zone bezeichnet.
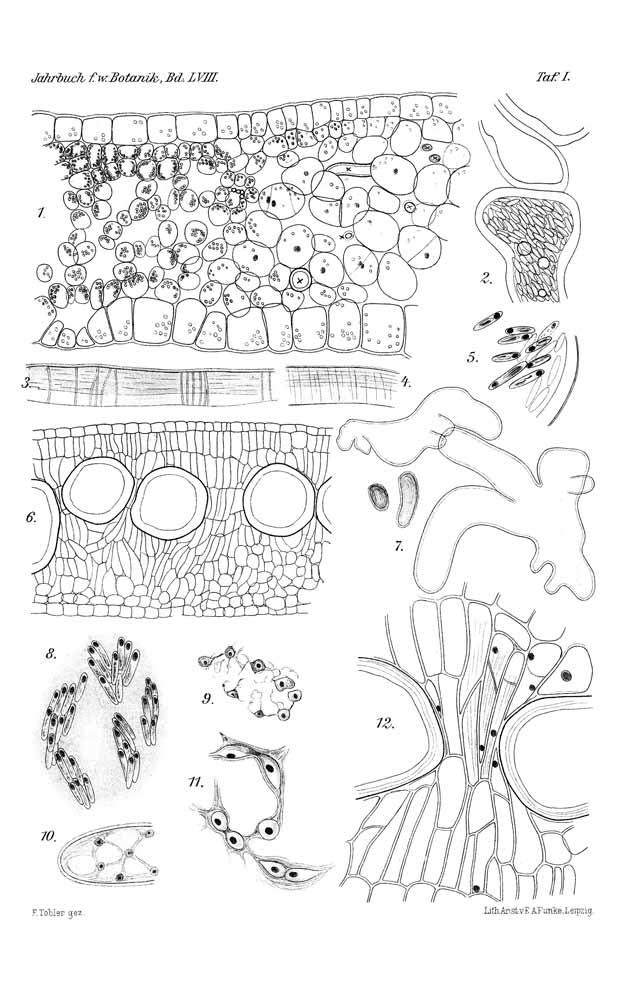
Von solchen Zuständen lassen sich leicht getreue Abbildungen durch unmittelbare Kopie auf photographischem Papier erhalten. Bei der festen Konsistenz der Blätter ist eine längere Exposition sehr gut möglich und völliger Abdruck erreichbar. Die Bilder sind natürlich dementsprechend, d. h. als Negative, zu bewerten (vgl. Fig. 1—3, S. 6 u. 7, und Fig. 11, S. 20).
Das Vorkommen des Schmarotzers ist so gut wie immer ein reichliches, wenn es überhaupt statthat. Auf den größeren Fiederblättchen können bis zu 30 Flecke auftreten, vom gleichen Blatt sind meist alle Fiederblättchen zugleich besiedelt. Die Gestalt der einzelnen befallenen Stellen oder Flecke auf dem Blatt ist zunächst eine kreisrunde, Abweichungen davon können nur dadurch entstehen, daß (im unteren Teil des Blattes besonders) starke Blattnerven die Ausbreitung des Schmarotzers anscheinend mit Erfolg hindern, sowie bei einander berührenden Flecken, wo dann Abplattung und Bildung deutlicher Grenzen je nach dem Altersverhältnis der Nebenbuhler zueinander die Folge sind (vgl. Textfig. 1). In diesen Fällen, wie auch bei Besiedelung der Blattränder mit dem Schmarotzer ist die Ähnlichkeit des Krankheitsbildes mit Koloniebildung von Schimmelpilzen außerordentlich. Sie deutet ohne weiteres darauf hin, daß in jedem Fleck das Erzeugnis einer Infektion vorliegt. Von ihrer Stelle aus hat nach allen Seiten gleichmäßig das Wachstum stattgefunden. Nicht ausgesprochen ist damit aber ohne weiteres schon die Entscheidung der Frage, ob jeder kreisrunde Fleck von einer Spore stammt und ein Individuum vorstellt oder aus mehreren Sporen entstanden, eine Kolonie vorstellt. Es wird unten darauf zurückzukommen sein.
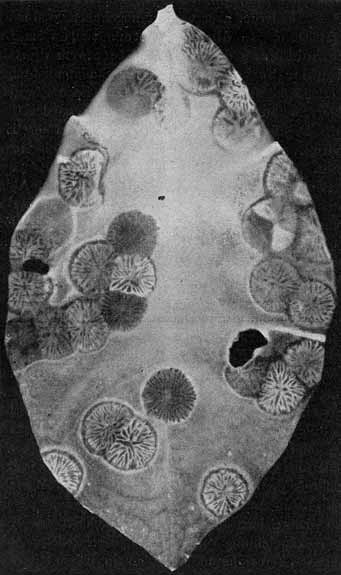
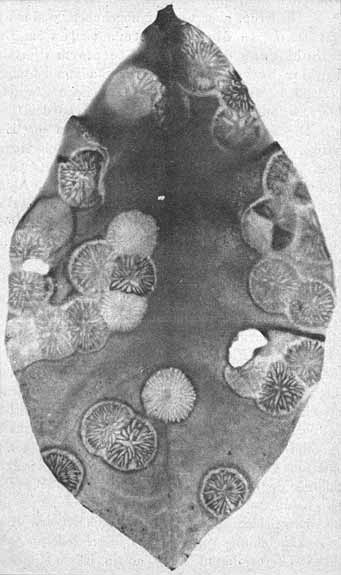
Fig. 1.
Phyllosiphon-Infektion auf alterndem Zamioculcas-Blatt (Selbstkopie, Negativ!). Ältere Zustände (im Negativ helle Sterne), jüngere (im Negativ dunkle). Links: ein nur in Sektoren reifender Stern. — Dunkler (im Negativ heller!) Ring bleibenden Chlorophylls um die ältesten Zustände. — 2. XII. 12.
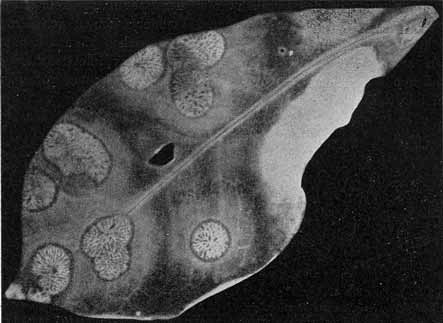
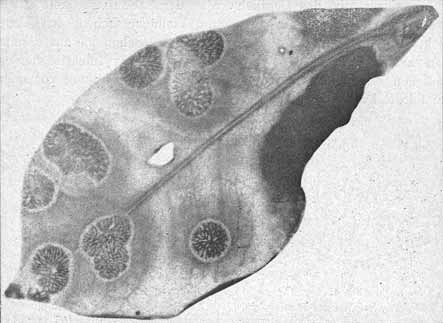
Fig. 2. Phyllosiphon-Infektion auf absterbendem Zamioculcas-Blatt (Selbstkopie, Negativ!). Alle Thalli ganz reif, Blattgewebe farblos werdend. Schläuche an der Spitze zum Teil schon entleert. — 23. I. 13.
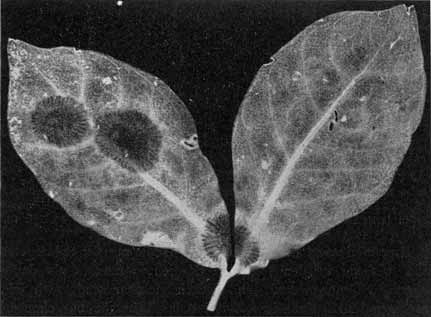

Fig. 3. Phyllosiphon-Infektion auf Zamioculcas (Selbstkopie, Negativ!).
An dem Grunde der beiden Fiedern ist anscheinend durch den gleichen Infektionsvorgang (einen Tropfen) Infektion an den Rändern erfolgt.
Übrigens tritt das Deutlichwerden der Sternfigur keineswegs im ganzen Fleck gleichmäßig auf. Vielmehr heben sich Teile (Sektoren) oft früher ab als die anderen. Schon hieraus könnte man auf verschiedene Individuen innerhalb eines Infektionsherdes schließen oder aber zum mindesten auf spätere Teilung vor oder bei der Reifung des Inhaltes.
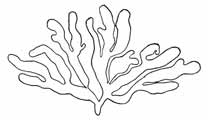
Fig. 4.
Reifendes Phyllosiphon aus
Zamioculcas, frei präpariert,
Sektor eines Sternes.
Vergr. etwa 100 ×. — 15. XII. 12. |
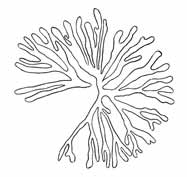
Fig. 5.
Ausgewachsener Thallus von
Phyllosiphon aus Zamioculcas-
Blatt, frei präpariert, Skizze, ohne
Berücksichtigung der Wanddicken.
Vergr. etwa 75 ×. |
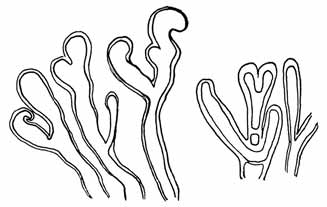
Fig. 6.
Astenden reifer Thalluspartien von Phyllosiphon
auf Zamioculcas, aus den Blättern frei präpariert.
Keulige Enden, unregelmäßige Wanddicke und
(rechts) Abgliederung von Teilen durch Zellulose-
pfropfen und Wände.
Vergr. etwa 100 ×.— 15. XII. 12. |
Hierauf deuten auch Befunde bei Isolierung der Schmarotzerthalli, wie sie in den spätesten Stadien, wenn sie als dunkel-gefingerte Sternchen auf den Flecken sichtbar sind, sich leicht vornehmen läßt. Um diese Zeit ist das Wirtsgewebe schon sehr entleert (S. 11) und andererseits der Algenthallus im Besitz außerordentlich kräftiger Wandungen.
Im Gegensatz zu den Angaben für Phyllosiphon Arisari erfolgt die Reife bezw. Sporenbildung im Inhalt, denn das ist es, nicht durch Austrocknen, sondern gerade durch starke Feuchtigkeit wird sie gefördert. Blätter mit Schmarotzern, auch getrennt von der Pflanze, ja Teilstücke des Blattes mit Infektionsstellen, lassen in der feuchten Kammer, auch in Wasser oder auf feuchtem Waldboden die Thalli ganz ausreifen. Hierbei zerfällt und verfault natürlich das Wirtsgewebe. Und in derartigem Zustande kann man die Schmarotzer mit einem harten Pinsel oder Nadeln kurz vor der Reife frei präparieren. Bilder, wie sie Just unter Weglassung der Wirtsgewebselemente gegeben hat, habe ich daher leicht völlig ohne dies bekommen (Textfig. 4-6).
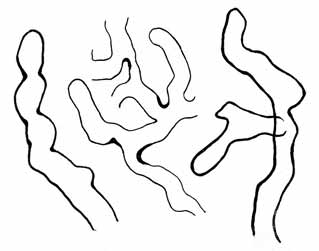
Fig. 7. Phyllosiphon in Zamioculcas, aus nicht gallen-
bildender Infektion. Knorriges unregelmäßigeres Wachstum,
unregelmäßige Wandverdickungen (Degeneration).
Vergr. 180 × (mittlere Figur etwas weniger).
Man erkennt hieran die Art und Häufigkeit der Verzweigung gut‚ sieht, daß am erwachsenen Thallus eine ziemlich gleichmäßige Stärke aller Thallusteile vorwiegt¹), sieht ferner die oft vorkommende Dichotomie des Thallus und wird die große Ähnlichkeit seiner Form mit der anderer Siphoneen gewahr. Es ergibt sich hierbei aber auch, daß ein sternförmiges Gebilde, ohne Verletzungen aufzuweisen, aus mehreren Teilen bestehen kann, die wenigstens jetzt keinen Zusammenhang mehr besitzen.
1) Nur in späteren Reifezuständen erscheinen gelegentlich keulig angeschwollene Schlauchenden, dasselbe ist der Fall bei sonst im Wachstum gehemmten und daher abweichenden Individuen (vgl. S. 10).
Man könnte annehmen, daß, ähnlich wie für Phyllosiphon Arisari angegeben¹), bei Reife des Inhaltes in einem Teil der Alge dessen Abschluß durch Wandbildung gegen den Rest erfolgt. Diese Erscheinung liegt auch vor: ich habe sie gefunden in Gestalt von Pfropfbildungen im Schlauche, so wie das auch bei Codiaceen vorkommt (Textfig. 7)²).
1) Vgl. Schmitz, 1880, und Buscalioni, 1898, S. 2.
2) Tobler, 1911, S. 85.
Damit aber kann das Bild der getrennten Thallussektoren wohl kaum verwechselt werden. Zudem kann ich im Verfolg des Entwicklungsganges zeigen, wie selbstverständlich die Entwicklung mehrerer Keime an einer Stelle des Blattes, also zentripetale Entwicklung einer Kolonie von Kreisform ist (s. S. 16).
Außerdem aber erfolgt auch innerhalb der Individuen, so wie für Phyllosiphon Arisari bekannt¹), die Sporenbildung von den Spitzen her, sobald diese abschließend zur Wandverdickung geschnitten sind, damit also das Wachstum des Thallus beendet ist.
1) Vgl. Schmitz, 1880, und Buscalioni, 1898, S. 2.
Es sei hier gleich daran erinnert, daß Ostreobium bei Wille (1909, S. 133) jetzt zu den Phyllosiphonaceen gerechnet ist, dort kommen solche Querwandandeutungen in der Tat vor.
Man darf hier nebenbei folgern, daß das Wachstum des Thallus an der Spitze erfolgt. Oft schreitet die Sporenbildung basipetal so (und in ihren Anfängen so schnell) fort, daß der ganze Thallus annähernd zu gleicher Zeit reift. Kleinere Individuen des Schmarotzers, die nur einen Teil eines Sterns ausmachen, reifen eher als die größeren, die den Rest des gleichen Blattfleckens bilden. Wenn es aber an einem Sternthallus zu der Erscheinung kommt, die ich als nachträgliche Abtrennung sporenreifer Thallusspitzen oder Aste ansehe, so reift offenbar meist der mittlere Rest nicht nach, es könnte sich dann um eine durch besondere Ernährungsumstände (z. B. Hunger, Erschöpfung des Wirtsgewebes) hervorgerufene Abtrennung handeln, wie sie ähnlich von Ernst bei Dichotomosiphon und von mir bei Codium beschrieben worden ist²).
2) Tobler, 1911, S. 85.
Im Zustand der Reife ist die Wand des Algenschlauches etwa 8—16 μ dick, am dicksten an den Stellen einer Einschnürung‚ am dünnsten an der Spitze. Die Wand ist deutlich geschichtet und zwar heben sich drei Schichten ab, eine äußere von nur 1 μ Dicke, eine mittlere 8—10 μ und eine innere 4—6 μ stark.
Mit Jod wird die Schichtung sehr klar, die äußerste Schicht färbt sich etwas, die übrigen nicht. Macht man den weiteren Zusatz von Schwefelsäure, so quillt die innere Schicht stark, die äußerste hebt sich bogig ab. Die Wand färbt sich mit Ausnahme der äußersten Schicht blau, mehr aber in der innersten Schicht, später löst sie sich auf.
Rutheniumrot färbt die Wand, nachdem auch die Wände des Wirtsgewebes durchgefärbt sind.
Orseillin BB in Wasser (Kallosereagens) färbt sehr gut und distinkt. Kanälchen und Schichtung treten sehr scharf hervor.
Chlorzinkjod färbt, wenn die Reaktion der Wirtsgewebswände deutlich wird, auch die äußersten Wandschichten des Algenschlauches violett, die inneren dagegen blau.
Demnach besteht die Wand der reifen Schmarotzerschläuche im wesentlichen aus Zellulose, die früher oder später in verschiedenen Graden vorhandene Kallose mag auch die Ungleichheiten der Zellulosereaktionsausfälle bedingen.
Außer den Schichtungen ist noch eine auffallende Struktur vorhanden, nämlich tüpfelartige Kanäle, die etwa senkrecht zur Oberfläche verlaufen und sich von der Innenseite bis mehr oder weniger weit nach außen verfolgen lassen. Sie haben einen Durchmesser von etwa 1 μ. Mit Jod und Schwefelsäure werden sie vorübergehend besonders deutlich.
Der Bau der Wand von Phyllosiphon Arisari, deren Zellulosenatur schon Kühn hervorhob, wurde von Schmitz (1882) als zweischichtig angeführt, die äußere Schicht nennt er kutikularisiert. Von Tüpfeln ist für dieses Objekt auch bei Buscalioni nichts erwähnt. Wohl aber hat Frau Weber für ihre Phytophysa Treubii eine Beschreibung ganz ähnlicher Art gegeben: Die Wand ist mit bis zur Oberfläche durchgehenden Kanälchen versehen, die, wie angenommen wird, einen Verkehr des Schmarotzers mit dem Wirt nach Art von Plasmodesmen ermöglichen. Die feinsten Eigenheiten des Baues entziehen sich natürlich der Sichtbarkeit, doch läßt die Webersche Abbildung (ihre Tafel XXIV, 7) vermuten, daß die Dimensionen und der Grad der Durchbohrung der Wand größer sind als bei meinem Phyllosiphon. Die Anschmiegung in und an den Wirtskörper ist freilich auch bei Phytophysa stärker.
Der Inhalt des reifen Thallus besteht im wesentlichen aus Aplanosporen, neben denen Protoplasmareste (nach der Entleerung) noch eben zu erkennen sind. Die Sporen haben meist
gleichmäßig längliche Gestalt, mit geringer Abrundung an den Schmalseiten (Fig. 5, Taf. I), sie messen ziemlich gleichmäßig 50:l2O μ. Im Inhalt ist reichlich Chlorophyll, mindestens die Hälfte des Inhalts ausmachend, oft ein großes, flaches Chromatophor an der Wand deutlich zu erkennen. Der Inhalt färbt sich mit Jod ziemlich stark, mit Dahlia, Giemsa u. a. Färbungen, am besten nach Heidenhain‚ wo der Kern deutlich hervortritt (vgl. S. 16). Der Kern liegt stets an dem einen Ende.
Reaktion mit Jod ergibt, daß keine Stärke (im reifen Zustand) vorliegt. Der Inhalt färbt sich nur stark gelb, dagegen färbt Osmiumsäure fast den ganzen Inhalt dunkel, das Öl ist in großen Tropfen zu erkennen.
4. Entwicklungsgang.
Das Freiwerden der Sporen erfolgt durch Platzen der immer praller werdenden Schläuche. Sie haben während der Sporenreife und unter gleichzeitiger Wandverdickung an Volumen stetig zugenommen. Dabei wird das Wirtsgewebe innerhalb des „Fleckes“ immer weicher und hinfälliger und in einem gewissen Zustande genügt die leiseste mechanische Reizung, um den Schlauch zum Zerplatzen zu bringen. Es quillt oder spritzt sofort ein dicker grünlicher Tropfen heraus, der die Sporen enthält. Es liegt dabei, soweit ich feststellen konnte, keine lokale Ausbildung an der Alge vor, die das Bersten des Schlauches erleichtert und vorbereitet. Vielmehr wird der Druck der reifenden Thallusäste unter gleichzeitiger Verdickung des quellungsfähigen Teiles der Wandung (vgl. S. 11) dauernd stärker, das Aufreißen erfolgt an den verhältnismäßig schwächsten Stellen (Spitzen, später wohl auch nahe den Zellulosepfropfen!), wo sich vorher der plasmatische Inhalt sammelt¹). Daß der Austritt der Sporen aus den Blättern sich durch die Spaltöffnungen vollzieht (wie bei Phyllosiphon²)), wird daraus sehr wahrscheinlich, daß man an entleerten Schläuchen das Blatt nicht verletzt findet, aber in den größten noch gebliebenen Zwischenzellräumen der Unterseite reichlich zurückgelassene Sporen vorfindet.
1) Was z. T. an Phytophysa erinnert, Weber, 1890.
2) Just, 1882.
Wie dieser Reiz zur Entleerung in der Natur erfolgt, ist schwer
zu beobachten, aber leicht vorzustellen. Daß Tiere anscheinend mit Vorliebe die vom Schmarotzer befallenen Flecke der Zamioculcas-Blätter fressen, wurde erwähnt (S. 3), es ist selbstverständlich, daß es dabei zur Entleerung reifer Schläuche kommt. Sie lassen sich auch von dem plötzlichen Aufbrechen kaum abschrecken, denn der Fraß pflegt gründlich zu erfolgen! Daneben aber tut die Bewegung der Blätter, das Schwanken im Luftzug, das Auffallen eines Regentropfens, wie ich beobachten konnte, ähnlichen Dienst. Die Berührung durch einen Teil einer Nachbarpflanze, ein Anstoßen einer unter den Zamioculcas wachsenden andern Pflanze genügen, um die Entleerung auszulösen. Daß eine Steigerung des Turgors in dem reifen Schlauche schließlich von selbst ein Platzen hervorrufen kann, entnehme ich daraus, daß ich einige Male an abgetrennten und geschützten Blättern gleichfalls reife Schläuche geplatzt fand.
Das Platzen eines reifen Sporangiums und Austreten des Sporentropfens bedeutet keineswegs die völlige Entleerung. Die ungleiche Reife, die in verschiedenen Teilen herrscht, wird vor völliger Entleerung zum Ausgleich des Druckes im Schlauch führen, ebenso aber tritt auch an engeren Stellen des Thallus eine Verstopfung durch den dickflüssigen Inhalt ein, wodurch die Entleerung sofort zum Stillstand gelangt. An solchen Stellen kann später Abtrennung durch einen Pfropfen aus Wandsubstanz (vgl. S. 10) erfolgen.
Der austretende Tropfen ist von großer Zähigkeit, sein Wassergehalt so gering, daß er selbst in der feuchten Atmosphäre Amanis in wenigen Stunden völlig eintrocknet. Er verschließt dabei die Ausflußstelle so dauerhaft, daß ein zweites Aufplatzen und Entleeren des gleichen Schlauches an anderer Stelle erfolgen kann.
Jedenfalls ist zur Sporenentleerung die Feuchtigkeit vonnöten, sie kann auch in Wasser erfolgen, wie nach Just (1882, S. 42) bei Phyllosiphon, und vollzieht sich am noch lebenden Wirtsgewebe in feuchtem Zustande. Reife und unreife Thalli erlitten in trocken ausgelegten Blättern keine Veränderung.
Die nächste Frage mußte sein, wie die derart in einem zähen Tropfen entleerten Sporen zur Neuinfektion gelangen. Da sie auf der Unterseite des Blattes mit dem Tropfen ankleben, so gelangen sie, wie ich leicht feststellen konnte, in der Nachbarschaft des Mutterthallus reichlich in die Spaltöffnungen und Interzellularen der Wirtspflanze hinein. Man findet unter den eingetrockneten
Tropfen zu Hunderten die Sporen im Gewebe. Aber offenbar keimen sie hier nie. Denn man findet niemals auf Blättern, die reife oder an Ausdehnung schon vollendete Schmarotzerthalli tragen, daneben junge Zustände. Wie oben erwähnt, sind diese Blätter ja auch meist am Ende ihrer Lebensperiode und es fehlt dem Wirtsgewebe daher dort auch schon sehr an Inhalt.
Die Aussaat erfolgt vielmehr zweifellos dadurch, daß Tropfen herunterfallen oder herunterfließen, und vollzieht sich an den jungen Blättern, die eingerollt am Grunde der Pflanzen stehen, oder an solchen, die sonst durch ihre Stellung unter den sporenentleerenden stehen. Ebenso sind auch nach der Eintrocknung Regen oder Tautropfen natürliche Verbreiter der ausgetretenen Sporen.
Hierfür findet man ganz augenfällige Beweise zunächst darin, daß in Gebüschen oder bei größeren Exemplaren und nur teilweiser Infektion mit dem Schmarotzer oft sehr gut die örtliche Anordnung der Infektionsstellen zueinander zu erkennen ist. Z. B. beobachtete ich an einem Felsen, der in verschiedenen Höhen auf humusbedeckten Stufen Exemplare von Zamioculcas trug, eine vertikale Reihe infizierter Exemplare in verschiedener Höhe, die jüngeren infizierten mehrfach deutlich unter Stellen mit reifendem Schmarotzer und den Spuren bereits erfolgten Sporenaustritts.
Ich will hier gleich anfügen, daß eine Verbreitung der Sporen durch Tiere sehr wohl möglich ist; wie die reifenden Schläuche ihres Plasmareichtums oder Ölgehalts wegen angefressen werden (vgl. S. 3), so waren an den eintrocknenden Tropfen auf den Blattunterseiten bisweilen kleine Fliegen zu sehen, die die feuchte Masse aufzusuchen scheinen und sehr wohl die Sporen forttragen können¹).
1) Übrigens siedeln sich in dem antrocknenden Sporentropfen sofort reichlich Pilze an.
Für die Art der Infektion, wie ich sie als die häufigere annehme‚ ist die Stellung der Blätter und Blattfiedern zur Senkrechten von Bedeutung. Stünden die aus dem Boden kommenden Blätter nicht wesentlich senkrecht und wären sie nicht eingerollt, so wäre Infektion durch einen Tropfen auf ihrer Unterseite nicht leicht vorstellbar. Sie behalten aber auch später noch oft der Vertikalen sehr nahe kommende Stellungen bei und können auch nach der Entrollung noch sehr wohl in der gedachten Weise infiziert werden.
Ich setze hier voraus, daß die Infektion nur durch die Spaltöffnungen erfolgt. Es ist freilich von Franke (1882) für Arisarum außer der (häufigeren) Infektion durch die Spaltöffnungen noch ein Eindringen des Phyllosiphon durch die Oberseite beschrieben worden. Ich habe für mein Objekt das nicht nachzuweisen vermocht.
Es wurden Infektionsversuche an gekennzeichneten Pflanzen im Freien vorgenommen. Sie sind mir gelungen. Kulturversuche der Sporen in Hängetropfen und auf künstlichem Substrat sind mir dagegen nicht geglückt¹). Ich wählte dazu infizierte Triebe, die sich im Zimmer in Wasser stehend leicht bewurzelt hatten, und pflanzte sie nahe dem Laboratorium ins Freie, d. h. in eine Gegend, wo auf Kilometerentfernung keine Zamioculcas mit Schmarotzer vorkam. Zu dieser Zeit waren die Schläuche alle noch unreif. Es entwickelten sich nun aus dem Grunde in kurzer Zeit junge Blätter, während gleichzeitig die Reife sich vollzog. Die Infektion wurde sodann an bezeichneten Stellen vermittels eines Pinsels von austretenden Tropfen her an den jungen Blättern des Grundes und den jüngeren bisher unbesiedelten Fiederchen oben vollzogen. Alle an den andern Blättern sichtbaren Infektionen wurden genau verzeichnet und weiter verfolgt. Die künstliche Infektion geschah teils auf der Oberseite, teils auf der Unterseite, außerdem auch an den Blattstielen. Die Versuche erstreckten sich über 2 Monate (Januar bis März).
1) Für Phyllosiphon Arisari machte Just vergebliche Versuche, für Phytophysa wollten die von Frau Weber gleichfalls nicht gelingen.
Oberseitige Infektion hatte keinen Erfolg. Am Stengel ist gleichfalls keine Infektion beobachtet.
An der Blattunterseite aber war die Infektion erfolgreich. Die Sporen waren reichlich in den Interzellularen zu finden und die (später zu beschreibenden) jüngsten Stadien etwa nach einem Monat überall zu erkennen.
Verschiedentlich war an jungen in den Versuch nicht einbezogenen Blättern oder Blatteilen, die unterhalb einer Versuchsstelle standen, doch Infektion zu finden. Sie konnte also auch hier nur durch ein Heruntertropfen, in Anbetracht der geringen übertragenen Menge von Sporenbrei‚ vielleicht in einem Tautropfen oder durch Regen geschehen sein, was auf den natürlichen Gang der Übertragung wieder Licht wirft (vgl. oben).
Die jüngsten Zustände der Keimung lassen erkennen, daß von den eingedrungenen immer eine Mehrzahl von Sporen keimt, daß aber der größte Teil dennoch nicht zur Entwicklung kommt. Die an einer Stelle im Präparat eines Flächenschnitts auffindbaren Sporen sind oft mehr als ein halbes Hundert, aber später finden sich von wirklich auskeimenden nur selten über 8-10 vereinigt. Auf eine solche Zahl geht demnach im Höchstfalle auch wohl die Bildung eines „Sterns“ zurück (vgl. S. 8).¹) Die ersten Keimungsbilder, die ich fand, zeigen unförmliche Auftreibung zu einem wurstartigen Körper, aus dem in unregelmäßiger und sichtlich durch den Raum beeinflußter Weise ein sich verzweigender Thallus hervorgeht. Dieser und ebenso der Haufen zusammenliegender Keimlinge entwickelt sich natürlich aus Gründen der Ernährung durch den Wirt (worüber im nächsten Abschnitt mehr) sehr bald zu einem kreisrunden Fleck, falls nicht durch besondere weniger zum Eindringen geeignete Gewebe des Wirts oder die Nachbarschaft eines andern Schmarotzerthallus die Entwicklung einseitig gehemmt wird (Textfig. 1—3).
1) Für Arisarum gilt seit Just als selbstverständlich, daß ein Fleck auf dem Blatte nur ein Individuum des Schmarotzers enthält.
Die jungen Zustände sind zuerst sehr chlorophyllarm (was auch für Phyllosiphon Arisari angegeben und dort ja Anlaß zur Auffassung als Pilz wurde, vgl. Buscalioni, S. 2f.). Sie enthalten Stärke. Später werden Chlorophyllkörner (doppelt so groß wie die Stärkekörner) sichtbar, sie haben längliche Gestalt. Es sind bei Beginn der Bildung des Sternthallus auch zahlreiche kleine Kerne nachweisbar. (Dies stimmt gut mit den Angaben von Schmitz [1882] überein.) Mit Beginn der Reife nimmt die Stärke aber wieder ab, die Kerne werden dann aber infolge der Zunahme des protoplasmatischen Inhalts und der Ölmengen viel undeutlicher. Vor der Anlage der Sporen ergeben sich Bilder einer Netzanordnung, wie sie Buscalioni am deutlichsten gibt (seine Abb. 11).
Stärke, die nicht rein blau wird mit Jod (Florideenstärke), die bei Verwandten vorkommen zu können scheint ²), habe ich nicht wahrgenommen.
2) Oltmanns, 1905, S. 324.
Die Kernverhältnisse meines Objektes sind außerordentlich interessante, sie zeigen eine weitgehende Übereinstimmung mit den Funden, die Buscalioni für Phyllosiphon Arisari gab.
Ich kann mich deshalb kürzer fassen. Ich habe mit der Heidenhainschen Färbung unter Verwendung der von Buscalioni vorgenommenen Erwärmung sehr gute Bilder erhalten (Fig. 5 und 8—11, Taf. I). In den Schlauchenden fand ich rundlich-eckige Kerne mit Nukleolus in bisweilen großer Regelmäßigkeit im Plasma (Fig. 10, Taf. I), wo dieses dicker wird, sind sie reichlicher und dann auch größer (Fig. 9, Taf. I). Daß sie in den Spitzen immer größer seien, als in den Thallusstrecken sonst, wie Buscalioni (S. 10) angibt, stimmt hier nicht.
In den inneren älteren Teilen treten ganz ähnlich wie bei Ph. Arisari die Fragmentationen auf (Fig. 11, Taf. I), die sehr bezeichnende und vollkommen deutliche Bilder boten. Die Vakuolen sind an den Endteilen (in jüngeren Stadien) gleichfalls sehr groß, später nehmen sie oft ab, die Dichtigkeit des Plasmas also zu (Fig. 9 u. 10, Taf. I).
Die Sporenbildung macht sich durch Anhäufung des Inhalts bemerkbar. Sie geschieht beim Vorhandensein größerer Vakuolen (also meist in weiter von der Spitze abliegenden Teilen!) in bündelartigen Ansammlungen von 8—12 Stück, daneben aber auch in den Plasmamassen, die diese verbinden (Fig. 8, Taf. I). In der Nähe der Spitzen stets, sonst aber auch vierlerorts bei Fehlen größerer Vakuolen (dichterer Plasmaanhäufung) geschieht die Sporenbildung in gleichmäßiger Verteilung. Um einzelne Kerne von sehr viel geringerer Dimension als die in der Fragmentation betroffenen, sammelt sich das Plasma. Ein größeres Chromatophor ist in den länglichen Sporen stets erkennbar, es färbt sich nach Heidenhain schwach mit (Fig. 5, Taf. I). Wenn man in den Anhäufungen der Sporen in Bündeln etwa vermeint, etwas wie die „Makrosporen“ sehen zu wollen, von denen Buscalioni spricht und die er verschiedentlich teils mehr allein, teils zwischen den gewöhnlichen Aplanosporen („Mikrosporen“) abbildet (seine Tafel, Abb. 15 u. 16), so muß ich betonen, daß ich nie etwas von einer gemeinsamen Hülle um die Sporenklümpchen sah, allerdings im Auffinden der vorbereitenden Zustände vor der Sporenbildung aus Zeitmangel keine so glatte Reihe von Bildern bei meinem Objekt besitze wie Buscalioni von dem seinen.
Zwischen den Sporen, von denen ich nur eine Größenordnung finde (von auffallender Gleichmäßigkeit!), nicht zwei wie Buscalioni für die Verwandte, bleiben Plasmareste zurück, wie schon oben erwähnt (S. 11). Eine Entwicklung der sie enthaltenden
und mit etwaigen Kernen versehenen Teile zu neuer Vegetation im Blatt¹) ist durch die andersartige Biologie dieses Phyllosiphon ausgeschlossen.
1) Oltmanns, a. a. 0., S. 325.
5. Verhältnisse des Schmarotzers zum Wirt.
Für das Verhältnis des Schmarotzers zum Wirt spielt der anatomische Bau des letzteren eine bedeutende Rolle.
Die oberseitige Epidermis des Blattes von Zamioculcas ist sehr fest, bei älteren sogar die Kutikula so kräftig, daß man schon deshalb ein Eindringen von dieser Seite kaum annehmen kann. Unter der Epidermis folgen eine oder zwei Schichten von Zellen, die ähnlich angeordnet stehen, wie sonst Palisadenzellen, aber in der Regel höchstens doppelt so hoch als breit sind. Zwischen ihnen sind wenig Interzellularen vorhanden. Diese sind aber in der anschließenden Masse des Schwammparenchyms ganz besonders reichlich und im einzelnen auch besonders groß. Eine Epidermis von größeren Zellen als die der Oberseite schließt das Blatt unterseits ab. Der Zartheit und dem Wasserreichtum ihrer Zellen wie dem Charakter der Hauptgewebsmasse des Blattes ist es zuzuschreiben, daß das Blatt von der Unterseite verhältnismäßig weichfleischig erscheinen kann.
Die durch die Spaltöffnungen eingedrungenen Sporen haben zunächst (wie auch Fig. 1, Taf. I beweist) die Möglichkeit, sich in jeder Richtung zu entwickeln und werden erst beim Erreichen größeren Umfangs zu allseitiger Einfügung in das Wirtsgewebe genötigt. Unzweifelhaft aber liegen sie schon vorher einseitig stets den Geweben an und äußern hierbei auf diese einen sehr deutlichen Einfluß. Die Berührung mit den Schmarotzerthalli veranlaßt das Gewebe des Blattes zu lebhafter Teilung. Vor und während dieser finden auffällige Kernverschiebungen statt. Die Kerne rücken dabei in die Nähe des Schmarotzers. Bei den unmittelbar anliegenden Zellen ist das am besten zu sehen, aber auch entferntere zeigen eine Verschiebung der Kerne in der Richtung auf den Schmarotzer hin und oft Anlegen des Kerns an die diesem zunächst liegende Wand (Textfig. 8). Hieraus kann ohne weiteres gefolgert werden, daß der Schmarotzer Reizstoffe aussondert, die auf osmotischem Wege in die Zellen des Wirtsgewebes
übertreten müssen, daraus aber ergibt sich auch die einfache Annahme, daß der Eindringling selbst auf diesem Wege seine Nahrung aus dem Wirtsgewebe bezieht. Die oben erwähnte Wandstruktur seiner älteren Teile erleichtert diesen Stoffverkehr mit dem Wirtsgewebe (S 11).
Die üppig einsetzende Zellvermehrung im Wirtsgewebe (Textfig. 9) bringt aber immer neue Zellen mit dem Schmarotzer in Berührung und steigert sich auf diese Weise selbst. So erfolgt die Anschwellung unter Zunahme des Blattgewebes sehr rasch. Die Grenze des besiedelten und nicht befallenen Blattgewebes läßt gut den Unterschied erkennen (Fig. 1, Taf. I).
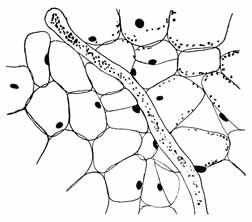
Fig. 8.
Jüngerer Schlauch von Phyllosiphon im Blatt von Zamioculcas,
mit Jod behandelt. Stärkegehalt des Schlauches zunehmend,
des Wirts (nur rechts angedeutet!) abnehmend. Annäherung
der Wirtskerne beginnt. Vergr. 160 ×.
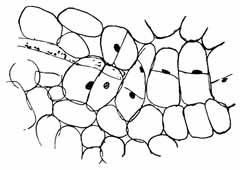
Fig. 9.
Junger Phyllosiphon-Schlauch im
Blatt von Zamioculcas. Beginn
der Wucherung im Wirtsgewebe
in der Nähe des Schmarotzers.
Vergr. 65 ×. |
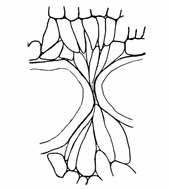
Fig. 10.
Reifende Phyllosiphon-Schläuche
im Blattgewebe von Zamioculcas.
Mechanische Beeinflussung, Zer-
rung und Zerdrückung der Galle.
Vergr. 170 ×. |
Im weiteren Verlauf werden aber auch die Thallusschläuche selbst an Umfang mindestens um das 50fache des Querschnittes vergrößert, den sie besaßen, als die Wucherung des Blattgewebes
eingeleitet wurde. Sie wachsen nun sicher länger als das Wirtsgewebe, das allmählich erschöpft ist und keine größeren Zwischenzellräume mehr erkennen läßt. Um diese Zeit, in der die Kerne der Blattgewebe der Degeneration (unter der üblichen Vergrößerung) verfallen, kommt es vielfach zu starken mechanischen Erfolgen im Gewebe, besonders an den Stellen, die zwischen verschiedenen Thallusästen eingekeilt sind. Zerrung, die deutlich noch Zellteilung veranlaßt, und schließlich ein Zerdrücktwerden sind in den Bildern nicht selten (Textfig. 10 und Fig. 6, Taf. I).
Es bliebe noch die Veränderung des Inhalts der Zellen zu berücksichtigen. Der Stärkegehalt der Blätter ist sehr groß. Bei Infektion durch den Schmarotzer nimmt er sichtlich ab (vgl. S. 3).
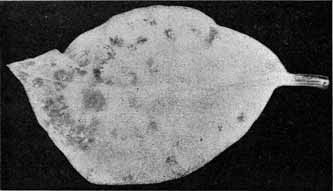
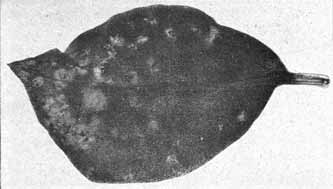
Fig. 11.
Phyllosiphon-Infektion auf jungem Zamioculcas-Blatt (Selbstkopie, Negativ!).
Junge Zustände, die Sternform der Thalli wird teilweise eben kenntlich. — 2. III. 13.
Er erhält sich an infizierten nur in der Epidermis, sowie an Stellen, an die auch der Schmarotzer nicht so wie anderwärts vorzudringen in der Lage ist. Wenn z. B. ein Thallus ein stärkeres Gefäßbündel berührt, so bleibt jenseits dessen der Stärkevorrat des Blattes erhalten. Daraus kann man schließen, daß der Schmarotzer ein stärkelösendes Enzym ausscheidet, das aber naturgemäß nur durch die lebenden Elemente des Wirtes geleitet wird.
Mit der Erschöpfung des Wirtsgewebes geht später auch ein Schwinden des Chlorophylls Hand in Hand, und zwar im umgekehrten Verhältnis zu der Vermehrung des Chlorophylls im Schmarotzer. Daher erscheinen dessen Thalli anfangs hell im Grün des Blattes, später dunkler auf einem immer heller werdenden Fleck.
Um diesen herum aber erscheint gegen Ende ein dunkler Ring (Textfig. 1 u. 2), das ist bleibendes Chlorophyll in einer Zeit, in der gegen Ende der Vegetation des Blattes sonst aus dem Gewebe das Chlorophyll allmählich schwindet. Das kann nur so aufgefaßt werden, daß der Einfluß des Schmarotzers die normalen Umwandlungsprozesse im Gewebe auch in dieser Zone noch hindert, vielleicht auch, daß ein von ihm ausgehender stofflicher Einfluß geradezu fixierend auf den Inhalt dieser Gewebe wirkt.
Sonst wäre noch zu bemerken, daß die Zellen mit degenerierenden Kernen zwischen den reifen Schläuchen der Alge starke Anhäufung von Kristallsand bergen¹).
1) Auch bei Phytophysa erwähnt Frau Weber (S. 175) das Vorkommen von auffallenden Kristallbildungen (Sphärokristallen) im anliegenden Wirtsgewebe nach Entleerung der Sporen, es wird aber nichts gesagt über den Stoff.
Aus diesen Beobachtungen erhellt im einzelnen aufs genaueste das Schmarotzertum der Alge im Gewebe der Zamioculcas-Blätter. Deutlicher in manchem als es für Phyllosiphon Arisari bekannt ist und in seiner formativen (gallebildenden) Wirkung eher vergleichbar mit dem für Phytophysa Treubii bekannt Gewordenen (Weber-van Bosse, 1890). In der Tat liegt auch hier eine wirkliche Gallenbildung vor. Das schließt keineswegs aus, daß auch dieses chlorophyllreiche Phyllosiphon in späteren Zuständen eigene Assimilationstätigkeit besitzt, wie das für Phyllosiphon Arisari Franke²) schon gezeigt und Nicolas mit genaueren Daten belegt hat.
2) Franke 1882, mir nur aus Buscalioni bekannt. Nicolas (1912) kennt anscheinend weder die Frankesche noch die Buscalionische Arbeit!
6. Ausbleiben der Gallenbildung.
Nicht alle sich als Infektion durch den Schmarotzer auf dem Blatt kenntlich machenden Stellen sind, wie oben schon erwähnt, auch Anschwellungen. Man findet, besonders auf dunklen, festen Blättern, Flecken von mehr gelber, ja rötlichgelber Färbung, die an Größe völlig den Infektionsstellen der Schmarotzer sonst entsprechen.
Ich glaubte anfangs, daß es sich hier um einen anderen Parasiten handele. Eine Ähnlichkeit im mikroskopischen Aussehen war gleichwohl sofort erkennbar. Schläuche von ähnlicher Art, ähnlichem Inhalt und ohne jede abweichende Differenzierung ließen zum mindesten auch auf eine Siphonee schließen.
Abweichend waren aber die Größenverhältnisse. Niemals wurden Schläuche von der Größe der größten des die geschwollenen Flecken bildenden Schmarotzers aufgefunden. Ferner war die Verzweigung des Thallus oft eine ganz wirre, viel reicher als bei dem Gallenbildner (Textfig. 7). Der einzelne Schlauch hatte unregelmäßigere Form, blasige Auftreibungen, Einbuchtungen u. dgl.
Auch hier sind zahlreiche Einzelindividuen in einem Flecke zu finden, ja an vielen Stellen kann wohl — soweit das Gewirr des Thallus das erkennen läßt — sogar eine sehr große Zahl einzelner Schmarotzer vorliegen, deren Thalli sich ineinander verflechten.
In einigen wenigen Fällen habe ich indessen auch von diesem Objekt weiter gediehene Zustände und endlich Sporenbildung gefunden. Es war das ein Thallus in nicht angeschwollenem Blattfleck, der z. T. den Übergang zu etwas lockerer Lagerung der Schläuche, auch Andeutung einer schwach von außen sichtbaren Sternfigur (wie die gewöhnlichen reifenden Gallen) und in einzelnen Teilen Sporenbildung zeigte. An diesen war die Wandverdickung etwas stärker, die Form aber immer noch die etwas wulstige, knollige der übrigen Partien. Die Sporen waren nach Größe und Form mit denen aus dem früher beschriebenen Organismus gleich. Bezeichnend ist aber der Unterschied in der Anlage der Sporangien, daß das gedrängte Wachstum der Thallusteile auch die zur Sporenbildung fortgeschrittenen förmlich einklemmt, daß die Wände an den Enden viel dicker sind als bei normalen. Wohl daher kommt es, daß sie nicht wie diese zum Platzen zu bringen sind!
Es unterliegt für mich keinem Zweifel, daß die Alge in den nicht geschwollenen Blattstellen mit der der typischen Galle übereinstimmt. Es fragt sich nur, welchen Umständen sie ihr besonderes Aussehen und ihr abweichendes Verhalten gegenüber dem Wirt (Ausbleiben der Gallenentwicklung) verdankt.
Offenbar ist die Entwicklung der Alge gehemmt. Wer Siphoneen in Kulturen gesehen hat (und auch bei zelligen Fadenalgen kommen ähnliche Formen der Degeneration vor), wird bei dem Habitus der Alge aus den nicht geschwollenen Flecken sofort an Degenerationsbilder erinnert. Ungunst der Ernährungsbedingungen ist Anlaß zur Störung des Habitus!
Die Störung äußert sich in veränderten Dimensionen, veränderter Verzweigungsart u. dgl., sie ist zugleich aber auch im
Ausbleiben der gestaltenden Reizwirkung gegenüber dem Wirt zu sehen. Daher Ausbleiben der Gallenbildung.
Die Ursache der ungünstigeren Wachstumsbedingungen liegt nun wohl am wahrscheinlichsten darin, daß es sich bei den betreffenden Blättern um ältere handelt. Sie sind vielfach dunkler und härter sowie inhaltsärmer, bieten also wohl auch dem Schmarotzer weniger gute Ansiedelungsbedingungen. Infektion hat stattgefunden, die Entwicklung aber hat nicht den normalen Verlauf genommen. Ohne völlig Herr des Wirtsgewebes zu werden, windet und dreht sich die Alge durch das anscheinend auch widerstandsfähigere Gewebe, kränkelt daher und wird morphologisch vielleicht ihrerseits vom Wirt beeinflußt, statt wie sonst ihn zu beeinflussen. Eine Schädigung findet aber insofern doch statt, als das Chlorophyll der besiedelten Gewebe schwindet. Es wird aber in anderer Weise zersetzt als sonst, denn die Stellen erhalten eine dunkelgelbe Farbe. Eine Zerstörung des Gewebes (Weichwerden bei Reife der Algenschläuche) tritt nicht ein.
Eine andere Annahme wäre die, daß deshalb kein normaler „Stern“-Thallus entsteht, weil zuviel Sporen an der Stelle zur Entwicklung kamen. In der Tat sind ja wohl stets mehr Individuen in einem der nicht geschwollenen Flecke enthalten als in einem der anderen. Aber damit würde schwer zu vereinigen sein, daß gewisse Blätter ausschließlich die eine abweichende Sorte von Flecken tragen, nur sehr selten fand ich zwischen den gewöhnlichen Gallenflecken solche ohne Anschwellung.
Es liegt deshalb trotzdem näher, anzunehmen, daß die geringere Eignung des Wirtsgewebes den Anlaß zur abweichenden Ausbildung des Schmarotzers gibt. Möglich daß eine Folge davon auch die Vielzahl der Keimlinge an einem Fleck gibt: es fehlt das rasch einsetzende Wachstum, das einzelnen den Vorrang verleiht und alle anderen unterdrückt. Möglich auch, daß nicht Mangel an Inhalt sowohl die Ungunst für den Schmarotzer im Wirtsgewebe vorstellt, sondern daß dieses, weil älter, imstande ist, gewisse Schutzstoffe zu erzeugen, die die Entwicklung des Eindringlings hemmen. Das bleibt Vermutungen überlassen. Sicher scheint mir, daß die Alge der angeschwollenen Flecken ein degeneriertes Vorkommen des anderen Organismus ist.
Es sei übrigens hier angefügt, daß wie Just (1882, S. 25) mitteilt, auch bei Phyllosiphon Arisari Schläuche vorkommen, die in ihrer Entwicklung z. B. hinsichtlich Chlorophyll und Sporenbildung,
gestört scheinen und zurückbleiben, andererseits sah Just auch mitten im Schlauch Sporenbildung. Ich stimme ihm nicht zu, wenn er diese Einzelbeobachtungen gegen die Schmitzsche Angabe von allgemein basipetaler Reife der Thallusteile ins Feld führt, ich glaube im ganzen, daß Just sehr viel mehr verschiedenartiges Material vor sich hatte und daher auch solche unvollkommen entwickelten Schmarotzer mit berücksichtigen zu müssen glaubte. Da das Phyllosiphon auf Arisarum keinen so erheblichen und sichtbaren Einfluß ausübt, wie das tropische auf seinen Wirt, so ist es weniger leicht möglich, die Entwicklung als unvollkommen und die Lage des Schmarotzers an der Stelle als Grund dafür zu erkennen.
Es ist bezeichnend, daß derart getrennte Entwicklung von verschiedenen Teilen des zellwandlosen Thallus, ähnlich wie auch ihre gelegentliche Abtrennung durch Wände (vgl. S. 9), gerade auch bei den in ihrer Ernährung spezialisierten Schmarotzern aus der Gruppe der Siphoneen vorkommt. Auch verschiedene andere Erscheinungen sprechen dafür, daß der zellwandlose Schlauch einer Siphonee morphologisch vielleicht Ähnlichkeit mit einer Einzelzelle hat, aber ernährungsphysiologisch und daher in der Entwicklung sehr wohl getrennten Einflüssen folgt.
7. Systematisches.
Zum Vergleich des neuen tropischen Organismus mit dem mehrfach untersuchten Phyllosiphon Arisari genügt es im wesentlichen, sich auf die Arbeit Buscalionis von 1898 zu beziehen, die in Willes Beschreibung der Familie (1897) noch nicht berücksichtigt ist. Buscalioni hat die Arbeiten von Schmitz und Just vortrefflich wiedergegeben, diese beiden Autoren haben über dem Streit um die Algen- oder Pilznatur des Fundes die Entwicklung weniger ausführlich behandelt, hier hat der Italiener an Ort und Stelle alles Nötige über die Sporenbildung und Kernverhältnisse feststellen können.
Von Lagerheims tropischen Phyllosiphon-Arten aus Araceen ist nicht viel mehr als einige Größenangaben bekannt, diese reichen aus, um meinen Gegenstand als völlig anderen zu erweisen.
Frau Webers Phytophysa scheint ein so völlig anderes Wesen, man möchte es seiner Form nach (auch nach der Form der Galle!) viel eher mit einem Synchytrium vergleichen, wenn es nicht Chlorophyll führte. Dieser interessante Schmarotzer hatte bisher nicht
allzuviel Vergleichspunkte mit Siphoneen, auch nicht mit Phyllosiphon Arisari.
Das Phyllosiphon von Zamioculcas nimmt vor allem in biologischer Hinsicht eine vermittelnde Stellung zwischen Phyllosiphon Arisari und Phytophysa Treubii ein. (Von den amerikanischen Phyllosiphon-Arten Lagerheims ist biologisch eigentlich nichts bekannt, die Biologie des Schmarotzers gibt aber die einzige Aufklärung über seine Stellung.) Morphologisch steht das neue Phyllosiphon der Phytophysa natürlich fern, aber es nähert sich ihr durch die Art seiner Lebensweise. Schmarotzer sind alle drei Phyllosiphonaceen. Phytophysa verdrängt Zellen des Wirtes und gibt Anlaß zu einer Wucherung. Phyllosiphon Arisari, dessen Beziehungen zu seinem Wirt Just und Buscalioni näher untersuchten, ist wohl als wirklicher Schmarotzer, aber doch in beschränktem Grade anzusprechen. (Buscalioni¹) bemerkt ausdrücklich, daß die Kerne der Wirtszellen wenig Veränderungen zeigen und diese selbst turgeszent bleiben.) Dagegen erweist sich das neue Phyllosiphon als gallenbildender Schmarotzer, es übt Wachstumsreiz auf das Wirtsgewebe aus, zerstört aber ganze Zellzüge z. T. rein mechanisch. Ähnlich wie bei Phytophysa deuten Poren in der Wand des Schmarotzers die Wege stofflichen Verkehrs an.
1) Buscalioni, S. 17. — Durchbohrungen und Zerdrückung von Zellen sollen niemals vorkommen, a. a. O.‚ S. 3 und Just, S. 36.
Hand in Hand mit diesen biologischen Vergleichspunkten drängen sich die morphologischen auf.
In der Gestalt steht das neue Phyllosiphon dem von Arisarum näher, ist aber, entsprechend seinem kräftigeren Wachstum und seinem Übergewicht über den Wirt, bezeichnender, regelmäßiger gebaut, wie der Vergleich der Habitusbilder lehrt. Sehr zu beachten sind die Ansätze zur Wandbildung (S. 9), die sich im Zusammenhang mit der Sporenbildung vorfinden.
Oltmanns (a. a. O.‚ S. 325) hebt den Mangel von Wandbildungen bei der Sporenbildung als starke Abweichung und Reduktion des Typus Phyllosiphon hervor, der seine Angliederung an andere Siphoneen erschwert. Hier aber findet sich eine Andeutung davon noch vor, Phyllosiphon Arisari ist darin offenbar stärker reduziert. Es ist ja wohl keineswegs nötig, daß die Ausbildung der Schmarotzer in allen Eigenschaften gleichmäßig erfolgt; denn
als gallenbildender Schmarotzer, auch durch die Wandausbildung für diese Eigenschaft steht der Bewohner von Zamioculcas der stärkst reduzierten Phytophysa wieder näher.
Der Gedanke Willes (1909), das etwas unklare Ostreobium von Bornet und Flahault mit seinen seltenen Querwandbildungen in die Phyllosiphonaceen einzureihen, erfährt hierdurch eine Bekräftigung.
Die Sporenbildung geht bei meinem Phyllosiphon sicher normal stets von den Spitzen aus; da meist wirklich zur Reife und zur Entleerung nur die Enden der Strahlen des Thallussterns gelangen, schon seltener der ganze Stern sich voll bis zu Ende entwickelt, so ist die Ähnlichkeit mit Sporangienbildung nicht abzulehnen.
Die Sporenform des neuen Phyllosiphon ist eine viel länglichere als die der bisher bekannten Arten, am ähnlichsten (schmalsten im Vergleich) sind die des Lagerheimschen Ph. maximus, das an Gesamtumfang der Flecke auf der Wirtspflanze¹) unseres weit überragt (l,5——6 cm!), aber viel zartere Schläuche, selbst zartere als Ph. Arisari, aufweist.
1) Es ist wohl zweifelhaft, ob diese aus je einem Individuum bestehen.
Die Frage nach dem Vorkommen von Makrosporen neben den Mikrosporen bleibt offen. Weder sind²) die Funde Buscalionis bei Phyllosiphon Arisari ganz klar, noch kann leicht entschieden werden, ob die oben (S. 17) beschriebene Gruppenbildung der Sporen bei meinem Phyllosiphon dazu in Beziehung zu setzen wäre.
2) So urteilt auch Oltmanns.
Die Eigenart der Kernteilung (Fragmentation) dürfte Phyllosiphon jetzt allgemein zugesprochen werden und die Weberschen Beobachtungen für Phytophysa entsprechen den Erwartungen. Da aber, worauf Buscalioni (S. 18, Anm. 2) verweist, auch bei Vaucheria und Valonia derlei vorkommt, so wird sie auch wohl sonst und keineswegs bloß unter dem reduzierenden Einfluß des Parasitismus in dieser Algengruppe verbreitet sein.